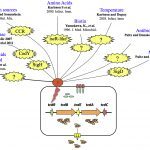
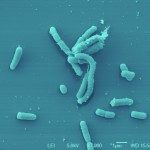
En Europe, Clostridiodes difficile, une bactérie Gram positif anaérobie stricte et sporulé, est la principale cause des infections nosocomiales post-antibiotiques intestinales chez l’adulte. Les infections à C. difficile (ICD) se produisent généralement chez les patients présentant un microbiote intestinal altéré. C. difficile est responsable de 15 à 25 % des diarrhées associées aux traitements antibiotiques et de la majorité des colites pseudomembraneuses. L’IDC est un processus qui se déroule en plusieurs étapes et comprend i) l’ingestion de spores de souches de C. difficile toxinogènes présentes dans l’environnement, ii) la germination des spores dans la lumière intestinale dysbiotique, iii) la colonisation intestinale des cellules végétatives (VC) de C. difficile et iv) la production de toxines responsables des symptômes entraînant la dissémination des spores. La virulence de C. difficile est principalement associée à la production de deux toxines: TcdA et le TcdB, qui exercent des effets délétères sur les cellules épithéliales du colon.
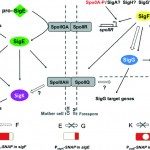
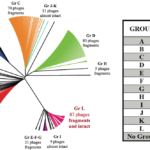
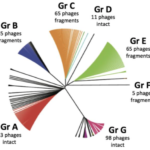
Cependant, d’autres facteurs de virulence semblent être impliqués au cours du cycle infectieux. Par conséquent, les objectifs de nos recherches sont de décrypter les étapes clés de la pathogenèse de C. difficile et en particulier l’étape de la colonisation intestinale qui est une condition préalable et essentielle avant la production des toxines. Nos études portent sur i) les stratégies adaptatives utilisées par C. difficile en réponse aux stress rencontrés durant l’infection telles que les mécanismes de résistance au stress oxydatif/nitrosatif et la formation de biofilm; ii) le réseau complexe de régulation de la sporulation de C. difficile et les relations qui existent entre les spores et les cellules du colon pendant la colonisation; iii) les mécanismes de régulation de la production de toxines en réponse aux voies métaboliques cellulaires et vi) l’impact des prophages dans la variabilité génétique des souches de C. difficile.