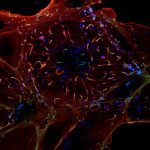
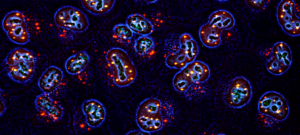
Notre laboratoire étudie les mécanismes épigénétiques et cellulaires impliqués dans les destins cellulaires normaux et pathologiques avec un accent particulier sur le développement embryonnaire précoce et le cancer.
Comprendre comment l’identité de nos cellules est maintenue dans les organismes multicellulaires et comment celle-ci est perdue lors de la transformation tumorale représentent un défi important en biologie et en médecine. L’identité cellulaire est dictée par des programmes transcriptionnels médiés par la configuration de la chromatine sous-jacente, cependant les mécanismes responsables de l’engagement vers tel ou tel destin cellulaire pour générer un organisme adulte ou le développement d’un cancer restent mal compris. Notamment, le rôle des modifications post-traductionnelles des protéines par d’autres protéines dans ce processus demeure énigmatique. Nous avons montré récemment que la modification des protéines associées à la chromatine par la petite protéine SUMO agit comme un gardien universel de l’identité de nos cellules. Une diminution des niveaux de sumoylation dans la cellule facilite les changements de destins cellulaires et donne naissance à des structures mimant l’embryon naturel à partir de cellules souches embryonnaires en culture.
Nous cherchons à comprendre le rôle de la protéine SUMO dans la biologie de la chromatine et l’expression des gènes, ainsi que son rôle chromatinien dans la mise en place des programmes transcriptionnels qui sous-tendent la plasticité cellulaire. Nos travaux reposent sur des approches ‘omics’ à l’échelle de la cellule unique, l’édition du génome, la biochimie chromatinienne, l’imagerie ou encore le développement d’organes et embryons synthétiques. Au-delà d’apporter une meilleure compréhension de la diversification cellulaire, ces travaux devraient conduire à exploiter la voie SUMO pour perfectionner la création d’embryons synthétiques proches des embryons naturels et pour reprogrammer les cellules cancéreuses. Nous développons également une approche globale pour clarifier les mécanismes impliqués dans le développement du cancer du foie chez les adolescents et les jeunes adultes. Nous espérons ainsi mieux comprendre les mécanismes fondamentaux impliqués dans la plasticité cellulaire normale et pathologique, avec l’objectif de mettre au point de nouvelles stratégies thérapeutiques visant à manipuler les niveaux de sumoylation dans le traitement du cancer et la médecine régénérative.