Notre laboratoire s’intéresse au parasite Trypanosoma brucei, responsable de la trypanosomiase humaine africaine (aussi appelée THA ou maladie du sommeil) et de la trypanosomiase animale (appelée Nagana). T. brucei est véhiculé par la mouche tsé-tsé qui le transmet à l’hôte par piqûre. La propagation du parasite dans son hôte mammifère se fait ensuite via le sang et la lymphe et peut être fatale si elle n’est pas traitée.
Chez le mammifère infecté, la surface du trypanosome est recouverte d’une couche dense de près de 10 millions d’une même glycoprotéine de surface, appelée VSG pour Variant Surface Glycoprotein, facilement détectable par le système immunitaire. Afin d’échapper à la réponse immunitaire de l’hôte T. brucei, comme d’autres pathogènes, a mis au point une stratégie de survie, appelée variation antigénique, pour modifier de façon continuelle cet antigène de surface majeur.
La variation antigénique chez T. brucei est le résultat d’un mécanisme de recombinaison recombinaison génétique et de réparation d’ADN contrôlé qui permet l’expression d’un seul variant VSG et l’inactivation concomitante des autres gènes VSG.
Ce sont ces mécanismes moléculaires de recombinaison génétique et de réparation d’ADN à la base de la virulence de T. brucei, que nous étudions au laboratoire. Nous utilisons pour cela des techniques d’interférence par ARN, de séquençage de seconde génération et d’imagerie cellulaire pour identifier de nouveaux gènes requis pour l’expression mono-allélique chez T. brucei.
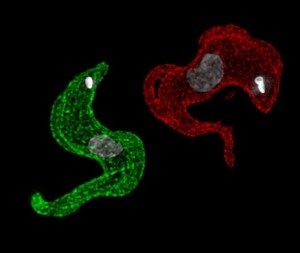 T. brucei exprimant 2 molécules différentes de VSG;
T. brucei exprimant 2 molécules différentes de VSG;
l’une rouge l’autre verte