Bienvenue au laboratoire « Biochimie membranaire et transport » !
Vous êtes-vous déjà demandé comment les cellules humaines se débarrassent des déchets ? Si oui, nous avons des réponses et des projets de recherche passionnants qui visent à révéler les principes fondamentaux de l’autophagie, la voie de recyclage cellulaire la plus polyvalente.
Qu’est-ce que l’Autophagie ?
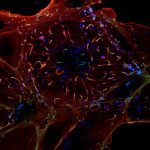
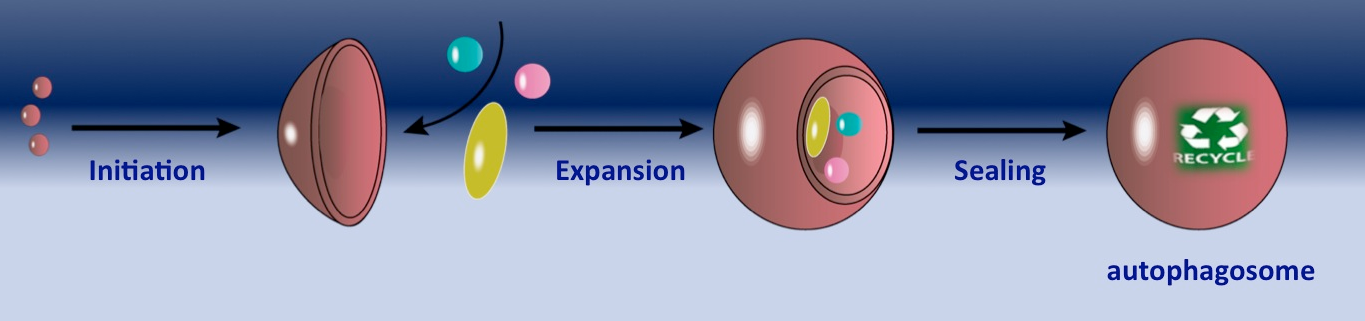
L’autophagie est une voie de dégradation cellulaire fascinante qui sélectionne le matériel cytoplasmique, le séquestre dans les autophagosomes et le transporte vers les lysosomes pour la dégradation. Le cargo autophagique, comprenant des organelles, des agrégats protéiques, des ribosomes et des complexes multienzymatiques, est capturé par une double membrane, appelée phagophore. La membrane s’étend autour du cargo pour l’engloutir entièrement et la fermeture de la membrane donne naissance à un autophagosome, qui est un « récipient de transport » qui livre son contenu aux lysosomes.
Pourquoi étudions-nous l’autophagie ?
On ne pourra jamais assez apprécier l’importance de l’autophagie pour l’homéostasie et la résistance au stress des cellules humaines. L’autophagie occupe une position centrale dans le catabolisme cellulaire et est interconnectée avec de nombreuses autres voies cellulaires. Une activité autophagique réduite ou des dysfonctionnements contribuent à l’apparition de nombreuses maladies humaines, notamment le cancer, la neurodégénérescence, les maladies métaboliques et immunitaires. Un tel déclin de l’autophagie se produit au cours du vieillissement, entraînant une prévalence plus élevée de maladies neurodégénératives et de cancers dans la population âgée. Une manipulation dirigée et précise de l’activité autophagique offre des options jusqu’ici inexplorées pour traiter ces maladies, notamment les maladies neurodégénératives pour lesquelles il n’existe aucun traitement efficace.
Comment étudions-nous l’autophagie ?
Nous combinons deux approches différentes pour étudier l’autophagie. La première vise à reconstituer la formation des autophagosomes dans un microtube à partir de composants purifiés. Nous utilisons des modèles de membrane qui sont assemblées à partir de lipides synthétiques et de protéines purifiées, que nous exprimons de manière recombinante à l’aide de cellules d’E. coli, d’insectes ou humaines.
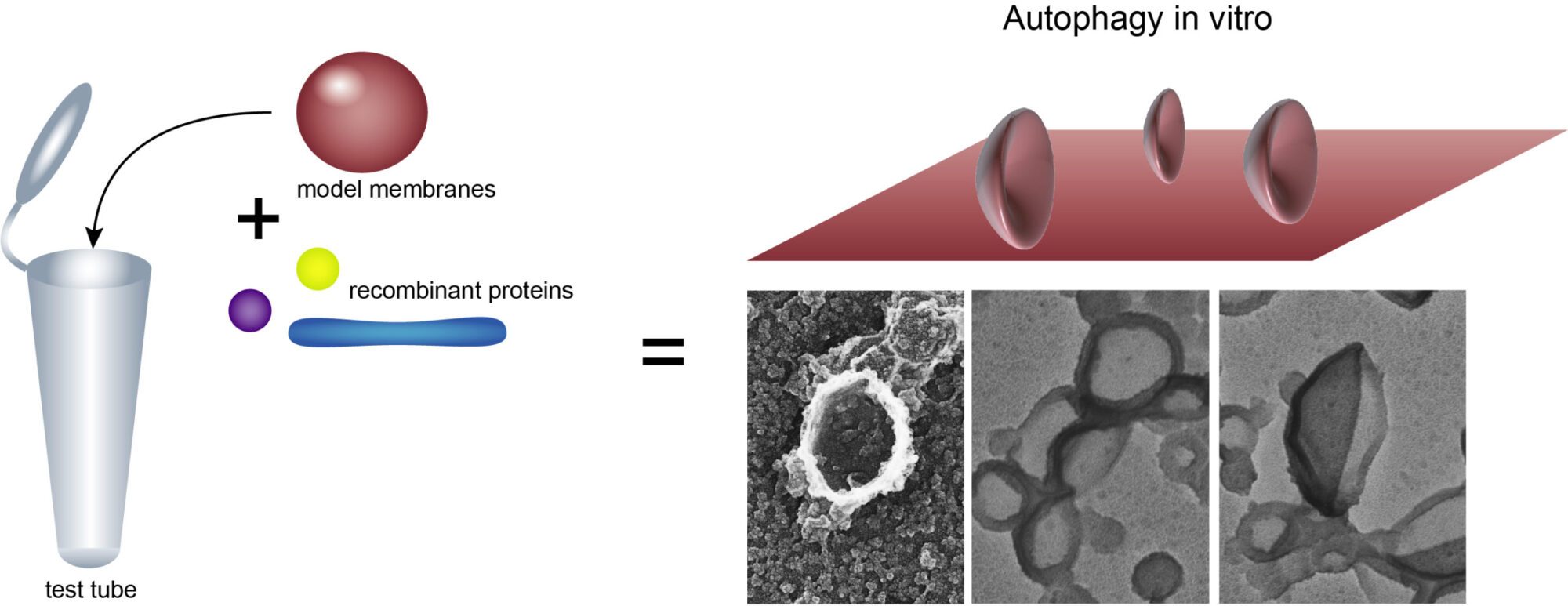
La deuxième approche combine la biologie cellulaire, la biochimie, l’analyse biophysique et les études structurales dans des cellules en culture. Ici, nous déplaçons une partie de la machinerie autophagique en les redirigeant vers d’autres membranes cellulaires, par exemple la membrane plasmique ou les membranes d’organelles. Cette approche de reconstitution « in vivo » permet d’étudier l’activité des composants de la machinerie de l’autophagie et leur fonction moléculaire indépendamment de l’autophagie canonique. Pour y parvenir, nous exprimons des protéines marquées par fluorescence et étudions leur interaction sur les membranes, par ex. imagerie de vie de fluorescence (FLIM). La caractéristique de l’autophagie est la formation de phagophores et d’autophagosomes, qui dépend d’un remodelage massif des membranes cellulaires. Afin de corréler la fonction des protéines avec de telles déformations membranaires, nous appliquons des techniques de microscopie électronique, notamment la microscopie corrélative, la coupe et le polissage à faisceau ionique – microscopie électronique à balayage et la tomographie cryo-électronique.
Autophagie et neurodégénérescence
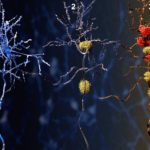
Nous avons récemment identifié une voie de l’autophagie spécialisée qui dégrade les agrégats de protéines dans les cellules neurales. Nous avons découvert que les autophagosomes qui transportent les agrégats de protéines vers les lysosomes sont décorés de LC3C, une petite protéine semblable à l’ubiquitine qui appartient à la famille des protéines ATG8. LC3C est attachée de manière covalente aux lipides de la membrane du phagophore et fournit une identité à ces autophagosomes. La destination des autophagosomes marqués LC3C est définie par TECPR1, une protéine qui se trouve sur un sous-type de lysosomes qui contiennent le lipide PtdIns(4)P dans leur membrane. TECPR1 interagit sélectivement avec LC3C pour recruter des agrégats de protéines contenant des autophagosomes. Le ciblage de TECPR1 sur les endosomes conduit à un mauvais tri des autophagosomes LC3C, qui ne sont plus délivrés aux lysosomes pour la dégradation mais s’accumulent plutôt au niveau des endosomes.
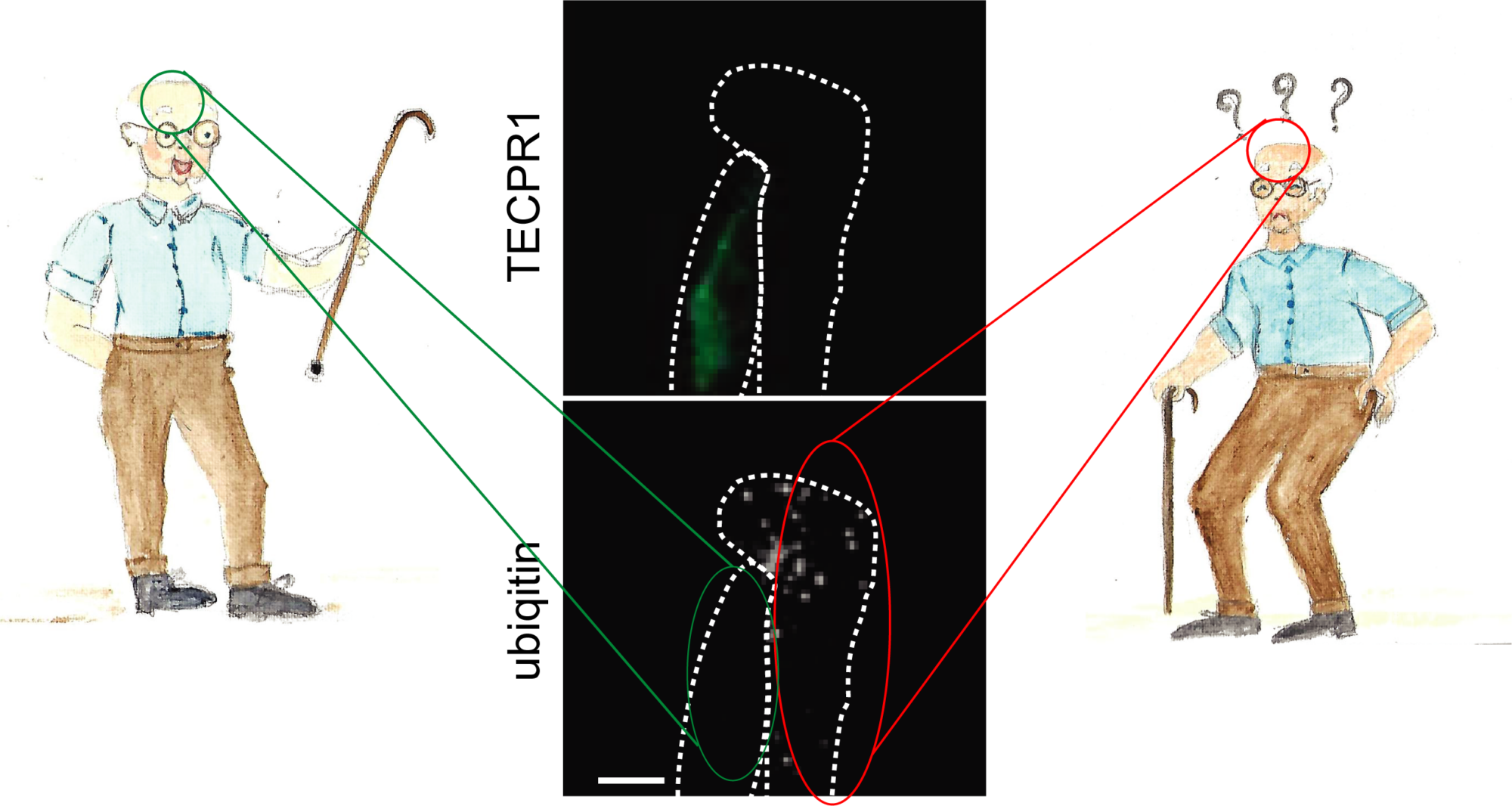
À droite : l’activité de l’autophagie diminue avec l’âge et, chez certaines personnes âgées, des agrégats de protéines s’accumulent dans les neurones du cerveau, entraînant une neurodégénérescence.
Nous avons découvert que l’autophagie altérée, qui implique une accumulation d’agrégats de protéines, peut être inversée. Si les niveaux de protéines TECPR1 dans les cellules neurales sont restaurés, l’activité autophagique dans ces cellules est augmentée. Cela conduit à une meilleure élimination des agrégats de protéines, protégeant les cellules neurales de la cytotoxicité et de la mort cellulaire. De nombreuses maladies neurodégénératives sont causées par une accumulation de protéines dont l’alpha-synucléine et Tau dans le cas des maladies d’Alzheimer et de Parkinson. Nos résultats démontrent que la neurodégénérescence peut être traitée en augmentant sélectivement les niveaux de TECPR1.
Si vous souhaitez en savoir plus sur ce projet, vous pouvez cliquer sur ce lien : Paper “TECPR1 promotes aggrephagy by direct recruitment of LC3C autophagosomes to lysosomes”
Autophagie non-sélective et réponse au stress
L’autophagie ne dégrade pas seulement les déchets cytoplasmiques, elle dégrade également le matériel cytoplasmique dans les cellules qui subissent un stress cytotoxique ou en réponse au jeûne. Mais il existe une différence majeure entre l’autophagie sélective du cargo cytoplasmique et l’autophagie non sélective du matériel cytoplasmique. Dans l’autophagie sélective, la membrane s’étend autour du cargo. La forme de la membrane est ainsi définie par la forme du cargo. Dans l’autophagie non sélective, le matériel cytoplasmique, qui est une solution visqueuse, doit être capturé par une membrane qui se comporte comme un liquide bidimensionnel. Ainsi, l’autophagie non sélective nécessite que les phagophores soient façonnés en calottes membranaires autonomes, qui s’élargissent sans mis en forme par le cargo, pour enfermer des parties du cytoplasme. Comment cela peut-il être réalisé, est restée une question pendant longtemps. Nous avons récemment découvert qu’un autre membre de la famille des protéines ATG8, LC3B et son complexe E3-ligase, qui catalyse la conjugaison de LC3B aux membranes, joue un rôle clé dans le processus. Les deux s’assemblent en échafaudages bidimensionnels qui déforment les membranes donneuses plates en « cups ». En reconstituant ce processus sur un modèle de membrane in vitro et sur la membrane plasmique des cellules, nous avons révélé des informations sans précédent sur le mécanisme moléculaire de ce processus et identifié une sous-unité du complexe E3 ligase, ATG16L1, comme moteur clé de la formation de la « cup ».
Si vous souhaitez en savoir plus sur ce projet, vous pouvez lire l’histoire complète sur : Preprint “Phagophore formation by the autophagy conjugation machinery”
Sortie annuelle au Parc Astérix, juin 2024:
Fête de Noël 2022:
Activités sociales 2019:
Fête d’anniversaire pour Thomas

Célébration du doctorat de Peter

2018:
Coupe du monde de football 2018 en France

Gâteau d’anniversaire pour Thomas

Gâteau d’anniversaire pour Jagan

Gâteau d’anniversaire pour Peter

2017:
Fête de Noël