Lien vers Pubmed [PMID] – 25730860
Lien vers HAL – Cliquez ici
Lien DOI – 10.1073/pnas.1417864112
Proc Natl Acad Sci U S A 2015 Mar; 112(9): 2865-70
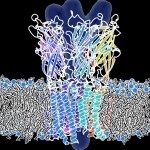
The glycine receptor (GlyR) is a pentameric ligand-gated ion channel (pLGIC) mediating inhibitory transmission in the nervous system. Its transmembrane domain (TMD) is the target of allosteric modulators such as general anesthetics and ethanol and is a major locus for hyperekplexic congenital mutations altering the allosteric transitions of activation or desensitization. We previously showed that the TMD of the human α1GlyR could be fused to the extracellular domain of GLIC, a bacterial pLGIC, to form a functional chimera called Lily. Here, we overexpress Lily in Schneider 2 insect cells and solve its structure by X-ray crystallography at 3.5 Å resolution. The TMD of the α1GlyR adopts a closed-channel conformation involving a single ring of hydrophobic residues at the center of the pore. Electrophysiological recordings show that the phenotypes of key allosteric mutations of the α1GlyR, scattered all along the pore, are qualitatively preserved in this chimera, including those that confer decreased sensitivity to agonists, constitutive activity, decreased activation kinetics, or increased desensitization kinetics. Combined structural and functional data indicate a pore-opening mechanism for the α1GlyR, suggesting a structural explanation for the effect of some key hyperekplexic allosteric mutations. The first X-ray structure of the TMD of the α1GlyR solved here using GLIC as a scaffold paves the way for mechanistic investigation and design of allosteric modulators of a human receptor.