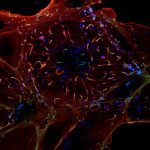
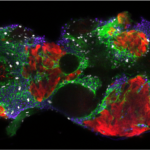
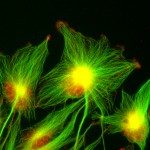
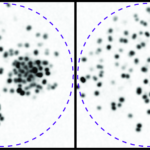
Nos recherches portent sur la polarisation et la migration des cellules normales et tumorales. Nous étudions plus spécifiquement les mécanismes contrôlant la migration des astrocytes dans les situations inflammatoires et l’invasion des glioblastomes. Les astrocytes sont des cellules gliales majeures du système nerveux central. Ils remplissent une large variété de fonctions permettant aux neurones de se développer, de survivre et de fonctionner correctement. Dans un cerveau adulte normal, les astrocytes sont essentiellement immobiles et ne présentent aucune morphologie polarisée évidente. Dans des situations pathologiques impliquant une inflammation du tissu cérébral, les astrocytes deviennent réactifs et se polarisent et migrent de manière collective en direction du site inflammatoire. Dans ces conditions, la polarisation et la migration des cellules sont étroitement régulées par l’environnement extracellulaire. Les astrocytes ou leurs précurseurs peuvent donner lieu à des tumeurs très invasives appelées gliomes. Les gliomes correspondent à la majorité des tumeurs cérébrales primaires et sont associés à un très mauvais pronostic. Les gliomes les plus agressifs, appelés glioblastomes, sont parmi les tumeurs les plus invasives. La capacité des cellules de glioblastome à échapper à la tumeur initiale et à migrer sur de longues distances leur permettent d’échapper à des traitements thérapeutiques classiques. Nos objectifs sont de caractériser les éléments du microenvironnement qui influencent la migration, d’élucider les mécanismes fondamentaux qui contrôlent la polarité des cellules en réponse aux conditions expérimentales, et de déterminer comment ces voies de signalisation contrôlent le cytosquelette de façon induire la migration des cellules. Ces études sont menées dans le cadre de la migration dans les astrocytes normaux dans différents modèles in vitro. Ce modèle nous permet alors d’identifier les altérations moléculaires responsables de la perte de polarité et du comportement migratoire anormal des cellules de glioblastomes analysées in vitro et in vivo.
Présentation
Groupes

Interactions hôte-pathogène et cancer chez le zebrafish

Membres
Projets
Our research focuses on the molecular mechanisms controlling migration and invasion of normal and tumoral cells. Our projects are centered on the control of cell polarity, the impact of cell-ECM and cell-cell interaction and the role of the cytoskeleton (actin, microtubules and intermediate filaments) and cytoskeletal crosstalk in cell mechanics and mechanotransduction during cell invasion through complex, mechanically challenging environment. We essentially work with normal glial cells and glioblastoma cells in in vitro and in vivo models.
Glioblastoma multiforme (GBM), also known as astrocytoma grade IV, is the most common type of primary brain tumors with a very poor prognosis for patients. The invasive character of GBM is one of the main contributors to the poor prognosis as cells migrate away from the tumor core, evade therapy and initiate recurrence. Tumor invasion is also what ultimately causes the death of patients by altering essential brain tissues. Current diagnostic methods cannot identify the invasive cells and do not accurately predict tumor spreading. Hence, there is an urgent need for a molecular signature of GBM cell invasive properties. This requires fundamental knowledge on the biology of GBM and their mechanisms of invasion through the healthy brain parenchyma. One general goal of the lab projects is to identify molecular alterations characteristic of invading GBM cells.
Projet Transversal
Financements
Publications
Télécharger-
2025Keratin intermediate filaments mechanically position melanin pigments for genome photoprotection., Nat Cell Biol 2025 Dec; (): .
-
2025Intermediate filaments promote glioblastoma cell invasion by controlling nuclear deformations and mechanosensitive expression of MMP14., Cell Rep 2025 Nov; 44(11): 116553.
-
2025Microtubule-Targeting Agents: Advances in Tubulin Binding and Small Molecule Therapy for Gliomas and Neurodegenerative Diseases., Int J Mol Sci 2025 Aug; 26(15): .
-
2025The SARS-CoV-2 envelope PDZ binding motif acts as a virulence factor disrupting host’s epithelial cell–cell junctions [brief report], Cellular and Molecular Biology Letters, 2025, 30 (1), pp.80. ⟨10.1186/s11658-025-00758-y⟩.
-
2025Comments on ‘Vimentin intermediate filaments coordinate actin stress fibers and podosomes to determine the extracellular matrix degradation by macrophages’., J Mol Cell Biol 2025 Feb; (): .
-
2025Microtubule-associated NAV3 regulates invasive phenotypes in glioblastoma cells., Brain Pathol 2025 Jan; 35(1): e13294.
-
2024Connexin 30 locally controls actin cytoskeleton and mechanical remodeling in motile astrocytes., Glia 2024 Oct; 72(10): 1915-1929.
-
2024Cytoskeletal crosstalk: A focus on intermediate filaments., Curr Opin Cell Biol 2024 Apr; 87(): 102325.
-
2024[SCRIB controls apical contractility during epithelial differentiation]., Med Sci (Paris) 2024 Apr; 40(4): 332-334.
-
2024The distinct localization of CDC42 isoforms is responsible for their specific functions during migration., J Cell Biol 2024 Mar; 223(3): .
-
+Voir la liste complète de publications
Images & Médias
Contact
Address : 25-28 Rue du Docteur Roux 75015, Paris France