Nous avons jusqu’ici approché les mécanismes moléculaires qui sous-tendent les fonctions auditives par l’identification des gènes responsables de surdité neurosensorielle chez l’homme. Plus généralement, la cochlée, organe sensoriel de l’audition chez les mammifères, est entrée dans l’ère moléculaire par la dissection génétique que nous en avons proposée et mise en œuvre. Cette stratégie visait à contourner les difficultés que rencontrent les analyses biochimiques et les techniques de biologie moléculaire classiques appliquées aux très petits nombres de cellules que comporte chacun des types cellulaires de la cochlée. S’y ajoute le fait que les machineries moléculaires impliquées dans les diverses fonctions des cellules cochléaires comportent des composants dont chacun d’eux est, en règle générale, très peu exprimé. Il en est ainsi de la machinerie de transduction mécano-électrique auditive des cellules sensorielles, dites cellules ciliées, qui convertit le stimulus mécanique sensoriel, les ondes sonores, en signaux électriques.
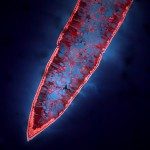
L’approche génétique dont l’efficacité est indifférente au nombre de cellules qui expriment le gène d’intérêt et au nombre de molécules que ce dernier code dans chaque cellule, s’est avérée particulièrement fructueuse. Aussitôt le premier gène responsable de surdité neurosensorielle identifié chez l’homme, grâce aux biophysiciens, physiologistes, biologistes cellulaires et biochimistes qui ont alors rejoint le laboratoire, il a été possible d’identifier les fonctions des protéines codées par ces gènes (abusivement nommés « gènes de surdité »), par l’obtention et l’intégration d’un ensemble de données complémentaires. Les modèles murins des surdités humaines alors générés (par inactivation génique ubiquitaire ou conditionnelle) ont permis de déterminer pour une même protéine, son rôle embryonnaire, postnatal ou voire associé à des conditions de stress (stress sonore en particulier). En regroupant les protéines codées par ces gènes au sein de complexes ou de réseaux protéiques, les mécanismes moléculaires qui sous-tendent diverses fonctions cochléaires ont ainsi été mis au jour. Le travail collaboratif mené avec le Professeur Paul Avan, visant à élucider les rôles des protéines codées par les gènes responsables de surdité précoce, nous a conduit à découvrir le rôle insoupçonné de plusieurs structures cochléaires. On peut citer celui de divers liens fibreux de la touffe ciliaire, structure de réception du son des cellules sensorielles, et site de la transduction auditive. Ainsi par exemple, chez l’enfant, la surdité DFNB16 (forme de surdité héréditaire la plus fréquente après DFNB1 due à l’atteinte atteinte du gène GJB2 qui code la connexine 26) a permis la découverte d’une protéine, la stéréociline, qui compose les liens fibreux de la touffe ciliaire des cellules ciliées externes (figure 1) et a ainsi révélé que ces derniers sont essentiels à l’ouverture coopérative des canaux de la transduction mécano-électrique auditive. En parallèle, nous avons mis au jour la pathogénie d’un très grand nombre de formes de surdité nous permettant d’en proposer une classification physiopathologique. Ces avancées ont fourni un socle de connaissances suffisant pour que la recherche de thérapies curatives de certaines formes de surdité devienne un objectif réaliste. Notre équipe est déjà engagée depuis plusieurs années dans le développement de thérapies géniques visant les formes de surdité héréditaire précoces au côté du groupe que dirige le Dr. Saaid Saffiedine (voir le projet du Dr. Saaid Saffiedine). Ci-dessous, seuls nos nouveaux projets de recherche sont présentés.
Figure 1 : Touffes ciliaires des cellules ciliées externes, à gauche de souris sauvages (Strc+/+), à droite de souris dépourvues de stéréociline (Strc-/-). La flèche noire indique les liens fibreux apicaux des cellules ciliées externes qui disparaissent en l’absence de stéréociline et la tête de flèche noire, le lien fibreux unique associé à la machinerie de transduction mécano-électrique.
Verpy, E., Weil, D., Leibovici, M. et al. Stereocilin-deficient mice reveal the origin of cochlear waveform distortions. Nature 456, 255–258 (2008). https://doi.org/10.1038/nature07380
MECANISMES FONDAMENTAUX DE L’AUDITION
Dans le but de progresser dans le déchiffrage des complexes et réseaux moléculaires impliqués dans les grandes fonctions des cellules sensorielles auditives, plus spécifiquement la transduction mécano-électrique auditive (et la genèse des distorsions sonores qui l’accompagne), et l’exocytose synaptique du neurotransmetteur (le glutamate), nous mettons en œuvre deux types d’approches complémentaires.
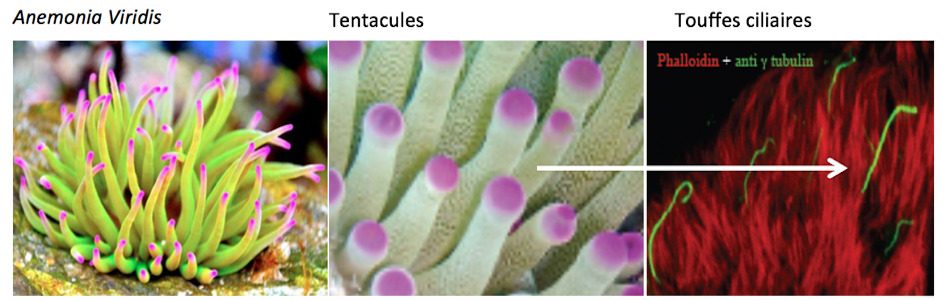
La première menée en collaboration avec le laboratoire du Dr.Eric Röttinger de l’Institut de Recherche sur le Cancer (IRCAN), (Inserm U1081-CNRS UMR7284) de Nice, vise à tirer parti de la conservation de certaines de ces fonctions, en particulier celle de la mécanotransduction, chez l’anémone de mer, Nematostella vectensis, un invertébré qui appartient au groupe des cnidaires (figure 2). La seconde menée en collaboration avec le Dr. Elise Pepermans du Centre fo Proteomics de l’Université d’Anvers dirigé par le Prof. Geert Baggerman, se propose de déchiffrer les complexes moléculaires impliqués dans les fonctions sus-mentionnées chez la souris en mettant à profit la spectrométrie de masse (couplée à la mobilité ionique) à très grande résolution (sensibilité théorique attomolaire). Ces deux approches contribueront aussi à l’identification de nouveaux gènes impliqués dans les surdités chez l’homme (voir ci-dessous).
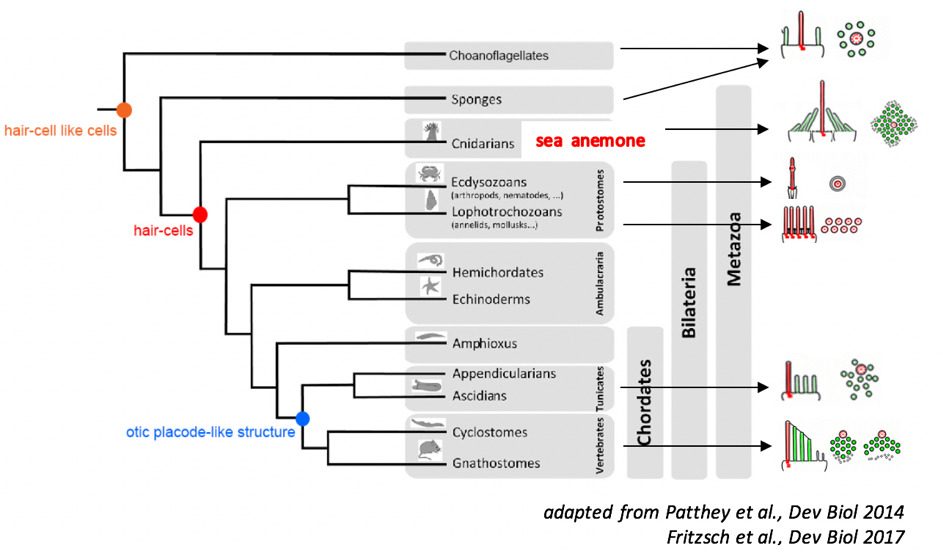
La machinerie moléculaire de la mécanotransduction de l’anémone de mer. Ce travail est fondé sur l’hypothèse selon laquelle une machinerie moléculaire de mécanotransduction ancestrale a donné naissance au cours de l’évolution d’une part à celle de la transduction mécano-électrique partagée par les cellules ciliées des organes sensoriels auditifs et vestibulaires (organes de l’équilibre) et d’autre part à celle que possèdent certains neurones sensoriels des tentacules d’anémones de mer (figure 2). Chez les vertébrés, les cellules ciliées portent à leur sommet une touffe ciliaire qui baigne dans un liquide, l’endolymphe. Elle joue le rôle d’antenne de détection des mouvements de ce liquide provoqués par les ondes sonores au sein de la cochlée et de détection de l’accélération dans le vestibule. Chez l’anémone de mer, la touffe ciliaire au sommet des neurones sensoriels détecte les vagues liquidiennes engendrées par les proies et les prédateurs qui passent à sa proximité. A l’appui de l’hypothèse d’homologie évoquée, – la morphologie des touffes ciliaires des neurones sensoriels de l’anémone de mer et des cellules ciliées des mammifères est voisine, la physiologie de leur transduction présente des caractéristiques communes et certains composants moléculaires de leur machinerie de transduction semblent être partagés. De la compréhension fine de la transduction au sein de la touffe ciliaire des anémones de mer, à l’échelle moléculaire, on peut escompter le moyen d’accéder efficacement à celle des cellules ciliées des mammifères. En effet, les anémones de mer se cultivent aisément ce qui permet la mise en œuvre d’ approches biochimiques classiques; la séquence de leur génome a été établie et elles sont génétiquement modifiables. Ce modèle doit aussi permettre de diminuer la pression qui s’exerce sur les vertébrés et en particulier, les rongeurs, pour acquérir des connaissances dans le domaine de l’audition.
Les machineries moléculaires qui sous-tendent les principales fonctions des cellules sensorielles auditives de la cochlée.
Les connaissances acquises sur ces machineries des cellules sensorielles sont encore fragmentaires. Il s’ensuit que l’on ignore encore, par exemple, le mode de stimulation du canal ionique de la transduction mécano-électrique auditive. Parce que les spectromètres de masse de dernière génération ont des sensibilités très accrues par rapport aux précédents, une approche biochimique des composants protéiques des machineries susmentionnées est aujourd’hui envisageable. Elle devrait permettre d’en identifier les protéines ubiquitaires, les modifications post-traductionnelles de la machinerie et la modulation de la composition de ses complexes/réseaux sous différentes conditions environnementales ou génétiques.
MEDECINE DE PRECISION
Par définition la médecine de précision (ou médecine personnalisée) utilise un ensemble de données biologiques, environnementales ou sociales propres au patient pour mieux apprécier son risque de développer de maladies, affiner les diagnostics et personnaliser les traitements préventifs et curatifs.
Notre objectif est de développer une médecine de précision dans deux domaines, celui du diagnostic des atteintes auditives et celui du développement de leur thérapie curative. Dans les deux cas sont visés principalement les surdités de l’adulte, au premier rang desquelles, la presbyacousie.
Trois axes de recherche seront développés.
– l’identification des gènes responsables de presbyacousie et des gènes et facteurs de susceptibilité/résistance aux atteintes auditives dues au bruit chez l’homme.
– l’élaboration de diagnostics multiparamétriques innovants des atteintes auditives
– le traitement par thérapie génique des surdités tardives ; certains traitements de la surdité précoce étant réalisés en collaboration avec le groupe du Dr Saaid Saffiedine.
La Recherche des gènes responsables de presbyacousie et des gènes de susceptibilité aux atteintes auditives liées au bruit :
Les atteintes auditives sont dominées par la perte auditive liée à l’âge ou presbyacousie, de loin la surdité neurosensorielle la plus fréquente. Selon l’OMS, aujourd’hui 320 millions de personnes âgées de 65 ans et plus, à travers le monde, souffrent de presbyacousie. Elle conduit à l’isolement social et la désocialisation qui affectent notablement la qualité de vie. Ces personnes sont menacées de dépression et de déclin cognitif qui entraînent une perte progressive d’autonomie. Des résultats récents suggèrent que la perte auditive à l’âge moyen et après l’âge moyen est le principal facteur de risque modifiable de la démence. Comme les autres troubles ou maladies communes, la presbyacousie est une atteinte multifactorielle comportant des composantes génétiques et environnementales. Au premier rang des facteurs environnementaux, la surexposition au bruit, est aujourd’hui le principal agent agresseur du système auditif.
Pour comprendre la physiopathologie de la presbyacousie plusieurs laboratoires se sont engagés dans la recherche des facteurs de prédisposition génétique. Les efforts pour déchiffrer la génétique de la presbyacousie ont beaucoup progressé ces dernières années, grâce au développement d’études d’association pangénomique (GWAS) portant sur des cohortes de patients de taille croissante. Quantité de variants génomiques associés à des gènes qui pourraient prédisposer au développement d’une presbyacousie ont ainsi été identifiés ; chacun d’eux, ne contribue que de façon très modeste au risque de presbyacousie. Notre démarche est autre. Elle consiste à s’interroger sur l’existence de formes monogéniques de presbyacousie qui pourraient donc d’une part potentiellement bénéficier de la thérapie génique et d’autre part peuvent très directement éclairer la physiopathologie. Les premiers résultats que nous déjà obtenus grâce à une étude multicentrique menée sur le territoire national, sont très encourageants ( figure 3). Ils révèlent que les gènes responsables des formes dominantes de surdité précoce, sont aussi à l’origine de formes sévères de presbyacousie.
En ce qui concerne les gènes qui chez l’homme sont responsables de la susceptibilité/résistance au bruit ou codent pour des facteurs de prédisposition, leur recherche a pour objectif principal de déchiffrer les réseaux moléculaires et voies de signalisation impliqués dans le but d’orienter la recherche de traitements protecteurs ou réparateurs des cellules atteintes, à côté du développement de la thérapie génique. Ce travail sera réalisé dans le cadre d’un consortium.
Développement de diagnostics multiparamétriques des atteintes auditives :
Affiner les diagnostics des atteintes auditives pour en proposer des thérapies adaptées, tel est l’objectif du développement de diagnostics multiparamétriques des atteintes auditives. Leur autre objectif est l’établissement de conditions qui permettent d’optimiser les tests de médicaments candidats. Ils permettraient d’optimiser les essais thérapeutiques et de définir les « profils » des répondeurs aux divers traitements à venir. Nous nous proposons de parvenir à une description fine et multiparamétrique des surdités humaines d’apparition tardive. Il s’agira d’obtenir des données psychophysiques, physiologiques et moléculaires et de les intégrer. C’est au CERIAH que dirige le Professeur Paul Avan (voir plus loin) avec le Professeur Hung Thai-Van et son équipe que seront développées les nécessaires innovations méthodologiques et instrumentales pour y parvenir et l’équipe « mécanismes fondamentaux de l’audition et médecine de précision » élaborera les tests moléculaires innovants.
Traiter la surdité d’apparition tardive :
Nous considérons le développement d’approches de thérapie génique.