About
[Version française]…
Understanding mechanisms underlying normal complex behaviours and the abnormalities that accompany most neuropathologies is a primary challenge in fundamental and biomedical research. However, optimal use of the large body of genetic, molecular, electrophysiological, behavioural and imaging techniques that provide new insights into cellular organisation at the microscopic level, and functional circuits at the macroscopic level, is hampered by the usual dissociation of these techniques. Today, the crucial challenge lies in the integration of these approaches in order to target a unified scientific question at multiple levels.
The subject of our entity is the functional analysis of brain circuits with a multi-level approach. Specifically, we aim to understand how nicotine acts on the brain, affects cognition, and causes addiction. Our strength lies in the association of different kinds of complementary expertise allowing to address this problem from an integrative point of view. Addiction to nicotine is typically an ‘integrated’ pathology including short-term receptor modification, and long term modification of circuit equilibrium and behaviours. Understanding such phenomena requires the development of new tools, like fibred fluorescence microscopy, see illustration. Nicotine addiction presents a serious social and public health problem, hence, the identification of the molecular mechanisms and circuits involved in nicotine reinforcement and cognition is urgent. Many aspects of the role of endogenous acetylcholine (ACh) can be targeted by administering nicotine to genetically modified animals (GMAs) and to study their response.
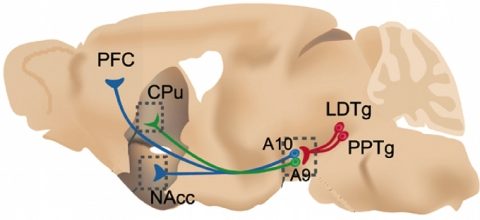
Our approach centres on the detailed analysis of genetically modified mice (GMMs) and transgenic rats, addressing the roles of nAChR subunits. The laboratory headed by Jean-Pierre Changeux has been the first to inactivate nAChR subunits in the mouse, and one among the very first worldwide to apply gene targeting to the brain. Members of his laboratory including ourselves have then been able to study the consequences of gene knock-outs at a variety of levels, from the molecular to behaviour and cognitive. As many subunits are expressed ubiquitously in the brain, the initial analysis of KO mice has identified those subunits that are necessary for a specific function, for example the executive functions, or nicotine self-administration. However, the brain area(s) that are sufficient to mediate a given phenotype remain to be resolved and delineated. Our working hypothesis is that the nAChRs play a pivotal role at the interface between the prefrontal cortex (PFC), the ventral tegmental area (VTA), and the amygdala. Therefore, these receptors are major players controlling decision making and motivational processes. Within this hypothesis we focus on the role of endogeneous ACh and nicotine in the modulation of the dopaminergic (DA), glutamatergic and GABAergic system.
Un projet de Neurobiologie Intégrative
La compréhension des mécanismes qui sous-tendent les comportements complexes normaux et les anomalies qui accompagnent la plupart des neuropathologies est un défi majeur pour la recherche fondamentale et biomédicale. Toutefois, l’utilisation optimale de l’ensemble des techniques génétiques, moléculaires, électrophysiologiques, comportementales et d’imagerie qui apportent de nouvelles connaissances sur l’organisation cellulaire au niveau microscopique, et sur les circuits fonctionnels au niveau macroscopique, est entravée par la dissociation habituelle de ces techniques. Aujourd’hui, le défi crucial réside dans l’intégration de ces approches afin de cibler une question scientifique unifiée à de multiples niveaux.
Le sujet de notre entité est l’analyse fonctionnelle des circuits cérébraux avec une approche à plusieurs niveaux. Plus précisément, nous cherchons à comprendre comment la nicotine agit sur le cerveau, affecte la cognition et provoque une dépendance. Notre force réside dans l’association de différents types d’expertises complémentaires permettant d’aborder ce problème d’un point de vue intégratif. L’addiction à la nicotine est généralement une pathologie “intégrée” comprenant la modification à court terme des récepteurs et la modification à long terme de l’équilibre des circuits et des comportements. La compréhension de ces phénomènes nécessite le développement de nouveaux outils, comme la microscopie à fluorescence fibrée, voir illustration. La dépendance à la nicotine présente un grave problème social et de santé publique, c’est pourquoi il est urgent d’identifier les mécanismes et les circuits moléculaires impliqués dans le renforcement de la nicotine et la cognition. De nombreux aspects du rôle de l’acétylcholine endogène (ACh) peuvent être ciblés en administrant de la nicotine à des animaux génétiquement modifiés (GMAs) et en étudiant leur réponse.
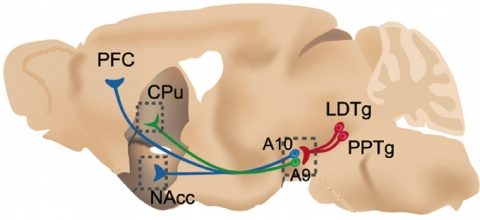
Notre approche est centrée sur l’analyse détaillée de souris génétiquement modifiées (SGM) et de rats transgéniques, en abordant les rôles des sous-unités nAChR. Le laboratoire dirigé par Jean-Pierre Changeux a été le premier à inactiver les sous-unités nAChR chez la souris, et l’un des tout premiers au monde à appliquer le ciblage des gènes au cerveau. Les membres de son laboratoire, dont nous faisons partie, ont ensuite pu étudier les conséquences de l’inactivation de gènes à différents niveaux, de la molécule au comportement et à la cognition. Comme de nombreuses sous-unités sont exprimées de manière omniprésente dans le cerveau, l’analyse initiale des souris KO a permis d’identifier les sous-unités nécessaires à une fonction spécifique, par exemple les fonctions exécutives, ou l’auto-administration de nicotine. Cependant, la ou les zones du cerveau qui sont suffisantes pour servir de médiateur pour un phénotype donné restent à résoudre et à délimiter. Notre hypothèse de travail est que les nAChRs jouent un rôle essentiel à l’interface entre le cortex préfrontal (PFC), la zone tegmentale ventrale (VTA) et l’amygdale. Par conséquent, ces récepteurs sont des acteurs majeurs qui contrôlent les processus de décision et de motivation. Dans cette hypothèse, nous nous concentrons sur le rôle de l’ACh endogène et de la nicotine dans la modulation du système dopaminergique (DA), glutamatergique et GABAergique.

